UFPR (Universidade Federal do Paraná) - Químico - PROGEPE (Pró-Reitoria de Gestão de Pessoas) - 2018
UFPR (Universidade Federal do Paraná) - Químico - PROGEPE (Pró-Reitoria de Gestão de Pessoas) - 2018
Sobre aspectos gerais da disciplina das licitações e contratos no âmbito da Administração Pública, assinale a alternativa correta.
|
a) As licitações serão efetuadas no local onde se situarem as empresas candidatas.
|
|
b) Tomada de preços é a modalidade de licitação entre interessados cadastrados ou que atenderem a todas as condições exigidas para cadastramento até o terceiro dia anterior à data do recebimento das propostas, observada a necessária qualificação.
|
|
c) Concurso é a modalidade de licitação entre quaisquer interessados que, na fase inicial de habilitação preliminar, comprovem possuir os requisitos mínimos de qualificação exigidos no edital para execução de seu objeto.
|
|
d) Concorrência é a modalidade de licitação entre quaisquer interessados para escolha de trabalho técnico, científico ou artístico, mediante a instituição de prêmios ou remuneração aos vencedores, conforme critérios constantes de edital publicado na imprensa oficial com antecedência mínima de 45 (quarenta e cinco) dias.
|
|
e) É permitida a combinação entre as modalidades de licitação previstas em lei.
|
A fórmula química de um composto representa sua composição em termos de símbolos químicos dos elementos que compõem uma determinada substância. A xantofila, uma substância encontrada em penas de aves e em flores, contém átomos de carbono, hidrogênio e oxigênio na razão 20:28:1. Sabendo que uma molécula desse composto tem seis átomos de oxigênio, qual é a fórmula química da xantofila?
|
a)
C20H28O. |
|
b)
C40H56O2. |
|
c)
C60H84O3. |
|
d)
C80H112O4. |
|
e)
C100H140O5 |
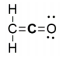
A molécula orgânica ceteno (C2H2O) tem a seguinte estrutura de Lewis:
Qual é a hibridização do átomo de carbono central do ceteno?
|
a)
sp. |
|
b)
sp2. |
|
c)
sp3. |
|
d)
sp3d. |
|
e)
sp2d2. |
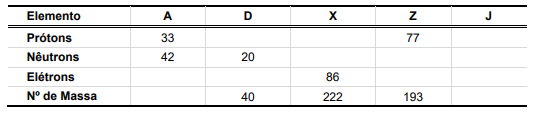
O avanço nas técnicas de análises de espécies químicas diversas permite o descobrimento de fenômenos importantes, como o ocorrido com a espectrometria de massas, técnica que permitiu identificar que átomos de um mesmo elemento podem apresentar massas diferentes. Essa observação foi definitiva para o refinamento do modelo nuclear, com a descoberta de uma nova partícula subatômica – o nêutron – e a identificação de isótopos. Considere a seguinte tabela:
Supondo que os elementos A, D, X, Z e J possam ocorrer na forma de isótopos, e com base nas informações contidas na tabela, é correto afirmar que:
|
a)
o isótopo D contém o mesmo número de prótons, nêutrons e elétrons e pode ser representado como 20D. |
|
b)
o isótopo do elemento X possui 136 prótons e 86 nêutrons, podendo ser representado como 222X. |
|
c)
o isótopo do elemento A possui 33 elétrons e número de massa 75, podendo ser representado como 75A. |
|
d)
o isótopo do elemento Z possui 116 nêutrons e 77 elétrons, podendo ser representado como 116Z. |
|
e)
sabendo que o número atômico do elemento J é 24, o isótopo 52J contém 12 prótons, 28 nêutrons e 12 elétrons. |
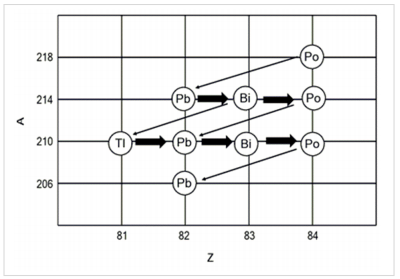
Alguns núcleos são instáveis e tendem a sofrer decaimento até que um núcleo mais estável seja formado. Esses núcleos decaem uma série de etapas e dão origem a uma série radioativa. Na figura a seguir, está mostrado o decaimento do 218Po até 206Pb.
Com relação a decaimento, considere as seguintes equações:
São equações de decaimento:
|
a) 1 e 3 apenas.
|
|
b) 1 e 4 apenas.
|
|
c) 2 e 3 apenas.
|
|
d) 2 e 4 apenas.
|
|
e) 1, 2 e 3 apenas.
|
Uma solução foi preparada pela dissolução de 500 mg de cloreto de potássio, 500 mg de sulfeto de potássio e 500 mg de fosfato de potássio em 500 mL de água. Qual é a concentração final, em mol L-1, de íons potássio em solução?
(Massas molares (g mol-1): O = 16; P = 31; S = 32; Cl = 35,5; K = 39,1)
|
a)
2,29 x 10-2. |
|
b)
2,71 x 10-2. |
|
c)
3,63 x 10-2. |
|
d)
4,10 x 10-2. |
|
e)
4,58 x 10-2. |
Qual é a massa, em gramas, de NaCl necessária para precipitar todos os íons prata presentes em 15,0 mL de solução de 0,125 mol L -1 de AgNO3?
(Massas molares (g mol-1): Na = 23; Cl = 35,5; Ag = 108; N = 14; O = 16)
|
a)
6,7 x 10-2. |
|
b)
1,1 x 10-1. |
|
c)
2,7 x 10-1. |
|
d) 7,31.
|
|
e) 58,5.
|
A fermentação da glicose (C 6H12O6) produz etanol (C2H6O) e dióxido de carbono (CO2), conforme a equação química não balanceada abaixo:

(Massas molares (g mol
-1): C = 12; H = 1; O = 16)
Qual é a massa, em gramas, de CO2 produzida quando 0,400 mol de glicose reage dessa maneira?
|
a) 88.
|
|
b) 72.
|
|
c) 44.
|
|
d) 35,2.
|
|
e) 17,6.
|
Equilíbrios químicos são fenômenos comuns às reações químicas. Em poucas palavras, numa reação que tende ou que já atingiu o equilíbrio, os reagentes se convertem em produtos e os produtos regeneram os reagentes, sendo que a posição equilíbrio pode ser determinada a partir da constante de equilíbrio (K eq), que leva em consideração a concentração, no equilíbrio, das espécies envolvidas. Considere que uma reação química genérica atingiu o equilíbrio químico e que a equação da constante de equilíbrio dessa reação é a apresentada a seguir:
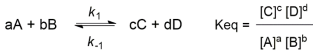
Assumindo que as equações acima são modelos que podem ser aplicados a qualquer reação química, é correto afirmar que, no equilíbrio:
1- as concentrações de A, B, C e D são iguais.
2- as concentrações de A, B, C e D não se alteram com o tempo.
3- a reação para de acontecer, logo, a formação de produtos é interrompida.
4- a constante de velocidade da reação direta (k1) é igual à da reação inversa (k-1).
Assinale a alternativa correta.
|
a) Somente a afirmativa 3 é verdadeira.
|
|
b) Somente as afirmativas 1 e 2 são verdadeiras.
|
|
c) Somente as afirmativas 2 e 4 são verdadeiras.
|
|
d) Somente as afirmativas 1, 3 e 4 são verdadeiras.
|
|
e) As afirmativas 1, 2, 3 e 4 são verdadeiras.
|
Os ácidos e bases são importantes em diversos processos químicos que ocorrem ao nosso redor, desde os industriais até os biológicos. Essas substâncias foram primeiro identificadas pelas propriedades de suas soluções aquosas.

Considerando a dissociação de um ácido genérico (HA) em água, conforme a equação mostrada acima, identifique como verdadeiras “V" ou falsas “F" as seguintes afirmativas:
( ) Se HA = HCl, ele estará completamente dissociado e a [H3O+] = [HCl]inicial.
( ) HA é o ácido conjugado da H2O enquanto H3O+ é o ácido conjugado de A-.
( ) HA é um ácido de Bronsted-Lowry e H2O é uma base de Bronsted-Lowry.
( ) Se HA = ácido acético, ele estará completamente dissociado e a [H3O+] = [ácido acético]inicial.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
|
a) F – F – V – F.
|
|
b) V – V – F – V.
|
|
c) F – V – F – V.
|
|
d) V – V – F – F.
|
|
e) V – F – V – F.
|