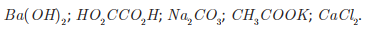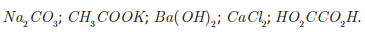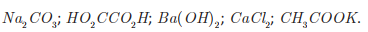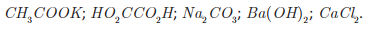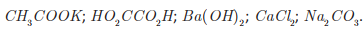ENADE (Exame Nacional de Desempenho de Estudantes) - Químico - INEP (Instituto Nacional de Estudos e Pesquisas Educacionais Anísio Teixeira) - 2017
ENADE (Exame Nacional de Desempenho de Estudantes) - Químico - INEP (Instituto Nacional de Estudos e Pesquisas Educacionais Anísio Teixeira) - 2017
Devido à sua muito baixa reatividade, acreditava-se que os gases nobres eram quimicamente inertes, concepção que deu nome a esses elementos e que perdurou até o ano de 1962, quando o químico inglês N. Bartlett sintetizou o primeiro composto de gás nobre. Atualmente, sabe-se que o xenônio apresenta energia de ionização suficientemente baixa para formar moléculas com átomos muito eletronegativos, especialmente com o flúor. Alguns desses fluoretos são usados como poderosos agentes oxidantes, conforme se pode observar na fluoração representada a seguir.

Com relação às informações apresentadas no texto, avalie as afirmações a seguir.
I. A geometria molecular do composto de gás nobre usado na fluoração da platina é quadrática plana.
II. A hibridação do átomo de xenônio no fluoreto oxidante é sp3d2.
III. A molécula do oxidante usado na fluoração da platina é apoiar.
É correto o que se afirma em
|
a) I, apenas.
|
|
b) II, apenas.
|
|
c) I e III, apenas.
|
|
d) II e III, apenas.
|
|
e) I, II e III.
|
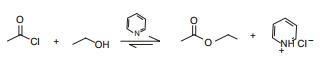
Uma reação importante dos ácidos carboxílicos e de seus derivados é a substituição nucleofílica. Os derivados de ácidos, tais como os cloretos de acila, são muito reativos e, por essa razão, são utilizados na obtenção de derivados de ácido como os ésteres, anidridos e amidas. Considere a síntese do acetato de etila a partir do cloreto de acetila e etanol, realizada na presença de piridina, que neutraliza o excesso de ácido clorídrico gerado.
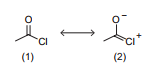
O cloreto de acetila apresenta duas estruturas de ressonância, conforme mostrado a seguir.
Considerando essas informações, avalie as afirmações a seguir.
I. Na reação mencionada, o nucleófilo ataca o carbono da carbonila e, em seguida, ocorre a eliminação do grupo abandonador, o que resulta na conversão de um derivado de ácido carboxílico em outro.
II. A reação favorável é a formação do éster, pois, quanto menos básico for o grupo abandonador, mais reativo será o composto formado.
III. No que se refere à formação do híbrido de ressonância do cloreto de acetila, quanto maior for a contribuição da estrutura de ressonância 2, mais reativo será o composto.
IV. O efeito indutivo retirador de elétrons do grupo abandonador aumenta a contribuição da estrutura de ressonância 2, o que explica a maior reatividade do cloreto de ácido em relação ao éster formado.
É correto apenas o que se afirma em
|
a) I e II.
|
|
b) II e III.
|
|
c) III e IV.
|
|
d) I,II e IV.
|
|
e) I,III e IV.
|
Alguns metais, como o ouro, o cobre e o ferro, são usados desde a antiguidade. O alumínio metálico, no entanto, só começou a ser usado no século XIX, produzido por eletrólise do Al2O3 na presença de fundente.
Considerando a necessidade da eletrólise ígnea para a obtenção do alumínio, avalie as afirmações a seguir.
I. A energia necessária para ionizar o composto Al2O3 é alta.
II. O caráter covalente é predominante nas ligações entre Al e O.
III. As cargas dos íons são elevadas, o que aumenta a atração entre os átomos.
É correto o que se afirma em
|
a) I, apenas.
|
|
b) II, apenas.
|
|
c) I e III, apenas.
|
|
d) II e III, apenas.
|
|
e) I, II e III.
|
Uma professora propôs como desafio a identificação de cinco soluções aquosas desconhecidas, de concentração igual a 2,0 g · L-1. A professora informou os cinco possíveis solutos: CaCl2, CH3 COOK, HO2CCO2H, Ba( OH)2 e Na2CO3.
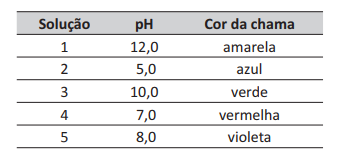
Para fazer a identificação, os alunos receberam um pH-metro, um bico de Bunsen eu m fio de Ni-Cr limpo cuja chama era azul. Os valores de pH e cores da chama das cinco soluções foram registrados na tabela a seguir.
Com base nessas informações, concluiu-se que as soluções 1, 2, 3, 4 e 5 contêm, respectivamente, os solutos
|
a)
|
|
b)
|
|
c)
|
|
d)
|
|
e)
|
A partir do estudo com espectroscopia UV-Visível, quatro amostras de soluções com diferentes concentrações conhecidas de aspirina foram analisadas, utilizando-se uma cubeta com caminho óptico de 1 cm. A curva analítica com os valores de absorbância (eixo y) por concentração de aspirina (eixo x) forneceu uma reta com os seguintes parâmetros: coeficiente linear = 1,0x10 -4 e coeficiente angular= 7,6x102 moi-1·L.
Considerando que o sistema estudado atende aos pressupostos da Lei de Lambert-Beer, avalie as afirmações a seguir.
I. O coeficiente de absortividade molar (ε), nas condições experimentais descritas, é 1,0 x 10-4 moi·L·cm-1.
II. Amostra de uma solução que contenha aspirina com absorbância de 0,2 apresentará concentração de 2,6 x 10-4 moi·L-1.
III. As concentrações de aspirina puderam ser determinadas devido à absorção se dar na região do visível.
IV. A variação da absorbância em função da concentração do analito tem relação direta com o coeficiente de absortividade da aspirina e com o comprimento do caminho óptico da cubeta.
É correto apenas o que se afirma em
|
a) I e III.
|
|
b) II e IV.
|
|
c) III e IV.
|
|
d) I, II e III.
|
|
e) I,II e IV.
|

A respeito dos processos eletroquímicos descritos no texto, avalie as afirmações a seguir.
I. A eletrólise é um processo termodinamicamente desfavorável.
II. A eletrólise envolve conversão de energia química em energia elétrica por meio de reações eletroquímicas.
III. As semirreações com maior potencial-padrão de redução ocorrem preferencialmente nos processos eletrolíticos.
IV. O processo de produção de gás hidrogênio a partir da urina é menos vantajoso energeticamente em comparação ao processo que utiliza água.
É correto apenas o que se afirma em
|
a) I e III.
|
|
b) I e IV.
|
|
c) II e IV.
|
|
d) I,II e III.
|
|
e) II,III e IV.
|
A reforma a vapor do metano é uma reação química endotérmica entre metano e água, conduzida a cerca de 20 atm e 800°C , na presença de níquel metálico, a partir da qual se produz uma mistura de gás hidrogênio e monóxido de carbono, que é muito utilizada em processos químicos industriais.
Sobre essa reação, avalie as afirmações a seguir.
I. Elevar a pressão do sistema reacional deslocaria o equilíbrio químico no sentido de formar mais gás hidrogênio e monóxido de carbono.
II. A utilização de temperaturas elevadas é favorável dos pontos de vista cinético e termodinâmico.
III. Aumentar a fração molar de vapor de água na entrada do reator eleva a quantidade produzida de gás hidrogênio.
IV. Empregar níquel metálico sob a forma de partículas finamente divididas aumenta o rendimento da reação.
É correto apenas o que se afirma em
|
a) I e III.
|
|
b) II e III.
|
|
c) II e IV.
|
|
d) I,II e IV.
|
|
e) I, III e IV.
|
A figura a seguir representa o processo de desnaturação da proteína ribonuclease por exposição a uma solução concentrada de ureia na presença de um agente redutor, seguida do processo de renaturação.
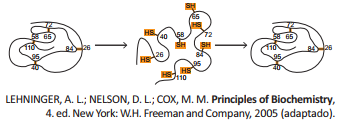
Sobre o processo descrito, assinale a opção correta.
|
a) A desnaturação apresentada ocorre pela ruptura das ligações peptídicas da proteína.
|
|
b) A atividade catalítica da proteína renaturada é exatamente a mesma da proteína original.
|
|
c) Um agente oxidante, como o permanganato de potássio, é capaz de reverter a redução e restaurar a atividade catalítica da ribonuclease.
|
|
d) A estrutura terciária da proteína apresentada é mantida por ligações de hidrogênio entre grupos de diferentes polaridades, como aminoácidos com átomos de nitrogênio protonados e hidrogênios ácidos de outros aminoácidos.
|
|
e) O aumento do pH do meio em que a ribonuclease estiver presente causará a protonação dos resíduos correspondentes de alguns aminoácidos e provocará a desnaturação enzimática, que pode ser revertida por meio da restauração do pH original.
|
A manga Palmer (Mangifera indica L.) destaca-se como fruta de alto valor comercial em muitas regiões do mundo, por apresentar ótima qualidade sensorial e ser rica em vitaminas A e C. Um estudo foi realizado com o objetivo de utilizar parâmetros cinéticos para avaliar a degradação de vitamina C de mangas armazenadas a 0°C, 6°C e 12°C, por 10 dias, conforme mostrado na tabela a seguir.
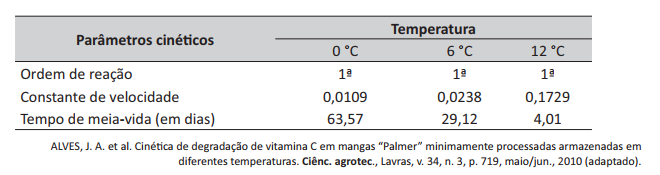
Com relação aos resultados apresentados, avalie as afirmações a seguir.
I. Para uma reação que possui cinética de 1ª ordem, o tempo necessário para ser consumido todo o reagente corresponde ao dobro do tempo de meia-vida.
II. Os parâmetros cinéticos obtidos indicam que o teor de vitamina C das mangas Palmer minimamente processadas decresce quando elas são armazenadas em temperaturas mais altas.
III. Durante o período do estudo, a perda de vitamina C em todas as amostras foi inferior a 50% do valor inicial, o que demonstra que o teor de vitamina C é parâmetro adequado para acompanhar a vida útil de mangas minimamente processadas.
É correto o que se afirma em
|
a) II, apenas.
|
|
b) III, apenas.
|
|
c) I e II, apenas.
|
|
d) I e III, apenas.
|
|
e) I, II e III.
|
Uma equação representativa do processo de formação do O
3 é 3O2(g) 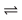 2O3(g). A altas altitudes, a radiação ultravioleta (UV) é intensa, porém a concentração de O2 é baixa para produzir muito oxigênio atômico. A baixas altitudes, a concentração de O2 é alta, porém a radiação UV é reduzida. A uma altitude intermediária, a produção de O3 é máxima. A presença de compostos clorados na atmosfera dá origem ao cloro atômico, que catalisa a decomposição do ozônio por meio das seguintes reações: Cl(g)+ O3(g)
2O3(g). A altas altitudes, a radiação ultravioleta (UV) é intensa, porém a concentração de O2 é baixa para produzir muito oxigênio atômico. A baixas altitudes, a concentração de O2 é alta, porém a radiação UV é reduzida. A uma altitude intermediária, a produção de O3 é máxima. A presença de compostos clorados na atmosfera dá origem ao cloro atômico, que catalisa a decomposição do ozônio por meio das seguintes reações: Cl(g)+ O3(g) 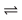 ClO(g)+ O2(g) e ClO(g)+ O3(g)
ClO(g)+ O2(g) e ClO(g)+ O3(g) 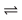 Cl(g)+ 2O2(g).
Cl(g)+ 2O2(g).
Sobre processos de formação e decomposição do ozônio, avalie as afirmações a seguir.
I. O cloro atômico altera a variação de entalpia do sistema 3O2 (g)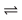 2O3(g).
2O3(g).
II. A variação de entalpia-padrão de formação do ozônio é diferente de zero.
III. A decomposição do ozônio é acompanhada de decréscimo da entropia do sistema.
É correto o que se afirma em
|
a) I, apenas.
|
|
b) II, apenas.
|
|
c) I e III, apenas.
|
|
d) II e III, apenas.
|
|
e) I, II e III.
|